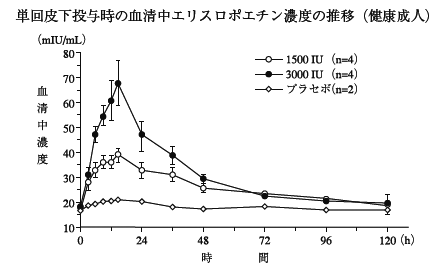
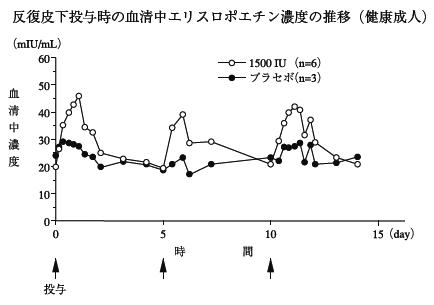
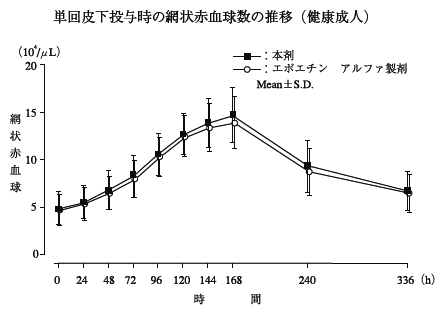
1
Besarab A, et al. N Engl J Med. 1998;339(9):584-90.
2
Singh AK, et al. N Engl J Med. 2006;355(20):2085-98.
3
Pfeffer MA, et al. N Engl J Med. 2009;361(21):2019-32.
4
Leyland-Jones B, et al. J Clin Oncol. 2005;23(25):5960-72.
5
Henke M, et al. Lancet. 2003;362(9392):1255-60.
6
Overgaard J, et al. J Clin Oncol. 2009;27(15s):302s.
7
Luksenburg H, et al. FDA Briefing Document. 2004;ODAC May 4
8
Smith RE Jr, et al. J Clin Oncol. 2008;26(7):1040-50.
9
角尾道夫, 他. 薬理と治療. 1993;21(11):4043-56.
10
角尾道夫, 他. 薬理と治療. 1993;21(11):4057-69.
11
尾本良三, 他. 医学のあゆみ, 1994;171(3):219-35.
12
社内資料:プラセボを対照薬とした二重盲検比較試験における追加評価と事後集計について(2010)
13
今井信雄, 他. 臨床医薬. 1990;6(Suppl.2):516-25.
14
河村明典, 他. 臨床医薬. 1990;6(Suppl.2):498-506.
15
Kawamura A, et al. Biotherapy. 1990;2(1):77-85.
16
社内資料:ラット慢性腎不全モデルにおける薬理作用 (1988)
17
社内資料:イヌ貧血モデルにおける薬理作用 (1988)
18
社内資料:瀉血ラット貧血モデルにおける薬理作用 (1989)
19
社内資料:瀉血イヌ貧血モデルにおける薬理作用 (1988)
20
社内資料:瀉血イヌ貧血モデルにおける薬理作用(静脈内投与) (1991)
21
社内資料:マウス造血系に及ぼす影響(1988)
22
社内資料:健康成人を対象とした臨床薬理試験(2010)